Indice
La patologia: insufficienza mitralica
L’insufficienza mitralica è la valvulopatia più comune nei paesi occidentali e la sua prevalenza cresce fortemente con l’età. Si calcola che al di sopra dei 75 anni circa il 10-15% dei pazienti presenta una insufficienza mitralica di grado moderato-severo.
L’insufficienza mitralica di grado severo ha un importante impatto sulla prognosi dei pazienti, sia in termini di mortalità, che in termini di riospedalizzazione. Numerosi studi hanno dimostrato che i pazienti con insufficienza mitralica di grado 3/4+ (ossia moderata severa) hanno una mortalità statisticamente più elevata rispetto ai pazienti con grado lieve o assente e un’incidenza di riospedalizzazione dell’80% superiore rispetto a pazienti con gradi minori di insufficienza mitralica. Va inoltre osservato che l’insufficienza mitralica è frequentemente sotto-diagnosticata. Basti pensare che in uno registro osservazionale del 2016 in cui era stato eseguito uno screening ecocardiografico su larga scala in pazienti >65 anni, asintomatici e in assenza di cardiopatia nota, si è evidenziato che oltre la metà era portatore di una valvulopatia non nota.
Si tratta pertanto di un problema con un impatto sociale e sanitario di vasta portata. L’insufficienza mitralica può essere legata a diversi meccanismi anatomo-funzionali. La classificazione principale differenzia le forme organiche e le forme funzionali.
- Nelle forme organiche l’insufficienza mitralica è secondaria a modificazioni anatomiche dell’apparato mitralico, la più frequente tra queste è il prolasso dei lembi valvolari.
- Le forme funzionali sono caratterizzate da disfunzione valvolare in assenza di lesioni anatomiche e sono secondarie al rimodellamento ventricolare, che può essere globale o regionale; tale rimodellamento causa cambiamenti funzionali e geometrici che coinvolgono i muscoli papillari e/o l’anello mitralico condizionando la coaptazione dei lembi (i lembi della valvola non combaciano in chiusura). L’insufficienza mitralica funzionale è in genere secondaria a cardiopatie ischemiche e/o dilatative.
Qualunque sia la sua causa, l’insufficienza mitralica è un predittore indipendente di mortalità. Per tale motivo le linee guida delle società americane ACC/AHA e le linee guida europee ESC pongono in classe IA (raccomandato) il trattamento chirurgico delle forme severe, nei pazienti sintomatici per affanno a riposo o da sforzi lievi o nei pazienti asintomatici ma con insufficienza ventricolare sinistra marcata.
Nonostante queste indicazioni delle linee guida, ad oggi un’importante percentuale di pazienti sintomatici, portatori di insufficienza mitralica severa non viene sottoposto a chirurgia riparativa o sostitutiva.
Nuove tecniche di riparazione percutanea: il sistema Mitraclip
Procedura
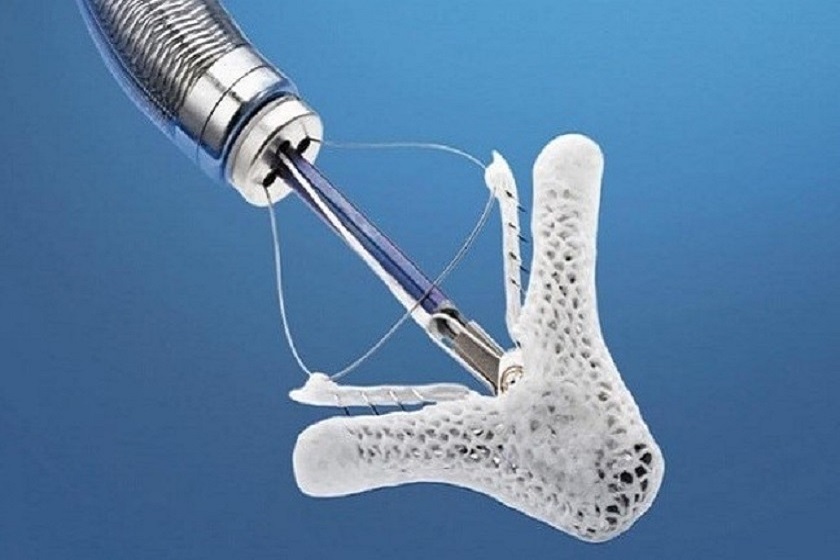
Il sistema MitraClip (Abbott Vascular, Abbott Park, Illinois, USA), consiste nell’applicazione di una “clip” (una molletta) in corrispondenza del rigurgito mitralico. Agganciando nella sede del rigurgito i due lembi valvolari, viene creato un punto di coaptazione (un nuovo punto di aggancio tra i lembi) persistente tra essi, generando un’apertura della valvola a doppio orifizio, con conseguente riduzione del rigurgito mitralico (vedi figura sottostante). Questo meccanismo riproduce del tutto la tecnica chirurgica descritta dal Prof. Alfieri, ma in questo caso l’applicazione del dispositivo avviene tramite un catetere introdotto dalla vena femorale comune destra con monitoraggio ecocardiografico transesofageo in anestesia generale.
Le attuali indicazioni al trattamento con MitraClip sono una severa IM, degenerativa o funzionale, in pazienti ad alto rischio cardiochirurgico. La decisione clinica del rischio chirurgico è complessa, richiede un approccio multidisciplinare, con il coinvolgimento del cardiologo clinico, dell’ecocardiografista e del cardiologo interventista, che decidono sulla fattibilità, sul beneficio in termini di miglioramento della classe funzionale NYHA (praticamente sulla riduzione della dispnea), della qualità della vita e di prognosi.
È necessaria inoltre l’opinione del cardiochirurgo e del cardioanestesista in termini di rischio di mortalità e morbilità perioperatoria e post – operatoria, utilizzando degli score chirurgici ma soprattutto valutando quelle comorbilità non comprese nel calcolo degli score, quali ad esempio la fragilità del pazient, la cirrosi epatica, il torace ostile, pregresse irradiazioni toraciche, malattia connettivale, malattie degenerative croniche del sistema nervoso centrale e ogni controindicazione alla circolazione extracorporea.
La selezione clinica e un’attenta valutazione ecocardiografica risultano fondamentali per una procedura sicura ed efficace. Il paziente deve avere un’aspettativa di vita di almeno 1 anno indipendentemente dalle comorbilità, e comunque deve essere in grado di sopportare e tollerare psicologicamente e fisicamente l’ospedalizzazione per la procedura e per gli accertamenti preliminari necessari, essere collaborante ed avere un supporto familiare adeguato e consapevole. È inoltre di notevole importanza il ruolo dell’ecocardiografista perché, in fase di valutazione, deve caratterizzare in maniera precisa e completa l’anatomia della valvola mitrale e verificare la fattibilità anatomica della procedura, secondo le misure richieste per il corretto impianto delle MitraClip.
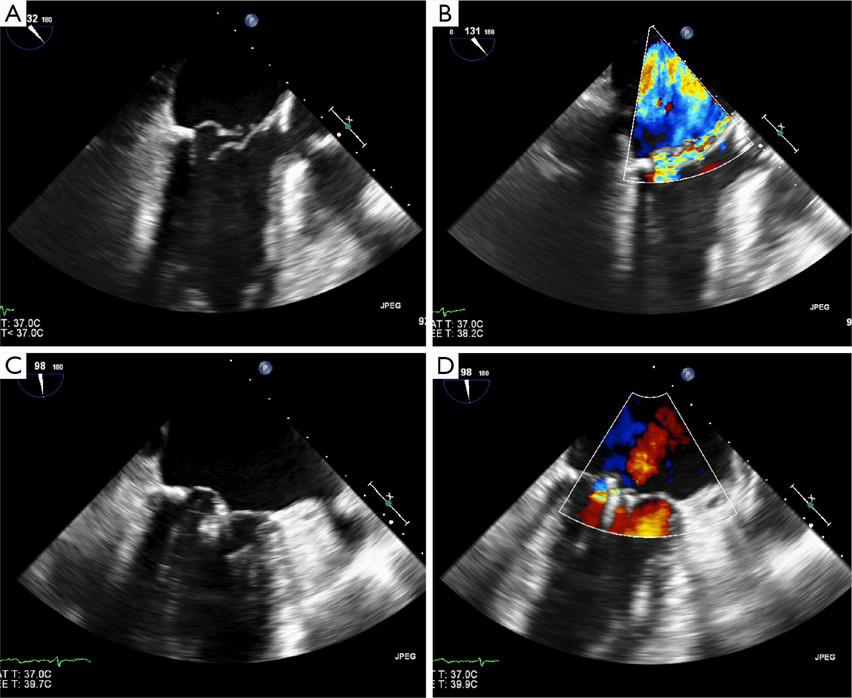
In parole semplici è l’ecocardiografista che deve stabilire se il disturbo della valvola ha delle caratteristica anatomiche tali che la Clip (molletta) possa agganciare i lembi e risolvere l’insufficienza. L’ecocardiografia transesofagea (ETE) è uno strumento fondamentale per la definizione morfologica della valvola mitrale.
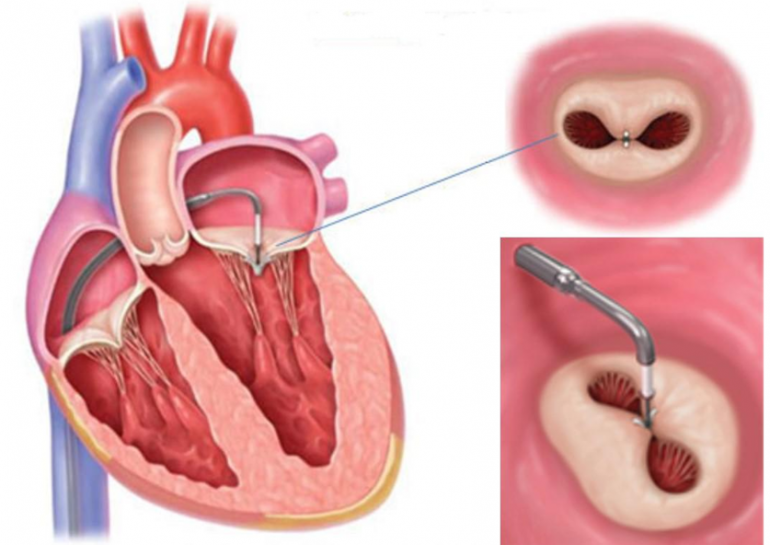
La procedura è effettuata nel laboratorio di Emodinamica da un’equipe dedicata di medici (Emodinamista, Anestesista cardiovascolare, Ecocardiografista) e personale infermieristico specializzato sotto monitoraggio fluoroscopico (raggi X). Il tutto viene effettuato con il paziente in anestesia generale e con l’ausilio dell’ ecocardiogramma transesofageo che serve per guidare tutte le manovre che l’operatore deve eseguire. Si incannula la vena femorale comune destra e un’arteria radiale per il monitoraggio invasivo della pressione arteriosa. S
alendo dalla vena femorale si giunge in atrio destro e si esegue la puntura del setto interatriale per potere avere accesso all’atrio sinistro (dove si trova la valvola mitrale). Tutte queste manovre vengono visualizzate e guidate dall’ecocardiografista: ad esempio visualizzando la zona del setto interatriale prima bucarlo con un ago dedicato. L’ecografista inoltre permette di visualizzare la posizione del catetere guida, di monitorare la fase di inserimento della clip in atrio sinistro, evitando traumi e perforazione delle pareti atriali, ed infine guida l’orientamento della clip perpendicolarmente al piano dell’anulus mitralico, centrato lungo la direzione del jet rigurgitante.
L’ecocardiografia tridimensionale, quando disponibile, fornisce un valido aiuto agli operatori soprattutto nella fase di orientamento, perché permette l’immediata visualizzazione della posizione spaziale del dispositivo in atrio sinistro e il suo rapporto con la valvola mitrale. Quando il dispositivo è stato correttamente allineato si procede con l’ancoraggio di entrambi i lembi (fase di grasping). Se è stato creato un doppio orifizio e l’ecocardiogramma ha confermato la significativa riduzione del rigurgito valvolare e il perfetto inserimento dei lembi all’interno della clip, le braccia della stessa vengono chiuse, bloccate e la clip rilasciata. Se la posizione della clip o il grasping sono giudicati insoddisfacenti, la clip può essere riaperta e riposizionata, prima del suo completo rilascio. Se necessario, possono essere impiantate più clip per ottenere il risultato sperato. Il paziente viene generalmente svegliato ed estubato in sala di emodinamica subito dopo la procedura, salvo complicanze maggiori, quindi transita per 24h in unità di terapia intensiva coronarica e 2 giorni in reparto.
Possibili complicanze
La procedura di Mitraclip può definirsi senza dubbio sicura. Le complicanze più pericolose infatti non superano il 2.5 % dei casi. Nello specifico la morte intraprocedurale (0.1%), il tamponamento cardiaco (0.5%), danneggiamento della struttura mitralica nativa(0.5%), ictus ischemico (0.2%). Altre complicanze possibili, ma di percentuale prossima allo zero sono: reazioni allergiche ai componenti utilizzati, aneurismi, pseudoaneurismi, fistola aterovenosa al sito di puntura venosa, aritmie, difetti al setto interatriale iatrogeni, embolizzazione del sistema, embolizzazione trombotica, sanguinamenti che richiedano trasfusioni
Indicazioni
Allo stato attuale non ci sono ancora evidenze chiare che tale procedura riduca la mortalità. Tuttavia è invece significativa la riduzione dei ricoveri per scompenso cardiaco ed il miglioramento della qualità di vita, aspetti non trascurabili in questi pazienti. Secondo i dati in possesso presso le società scientifiche, il successo procedurale è del 95%, il tempo medio di ospedalizzazione di 2.9 giorni, l’87% dei pazienti vengono dimessi presso il proprio domicilio e il 73% di riduzione di scompenso cardiaco nell’anno successivo all’impianto.
Alternative
L’alternativa terapeutica a questa procedura è la sola terapia medica che però in questa tipologia di pazienti ha dimostrato avere una ridotta efficacia. Nella maggioranza dei casi sono soprattutto le insufficienze mitraliche funzionali a non essere sottoposte a terapia chirurgica, perché minore è il consenso sull’ efficacia del trattamento e peggiori sono i risultati immediati e a distanza.
Cosa comporta vivere con una Mitraclip?
Solitamente il paziente non avverte alcuna differenza ed anzi se la procedura ha ottenuto un buon risultato la sua qualità della vita migliora sensibilmente. La sua capacità ad effettuare sforzi fisici è solitamente aumentata in modo importante, e l’affanno dei pazienti più sopportabile. Il paziente deve effettuare dei controlli cardiologici di routine solitamente il primo 15-30 giorni dopo l’impianto e poi solitamente ogni 3-6 mesi a seconda dei casi. Va tenuto inoltre conto di un piccolo rischio di infezione batterica della clip per interventi successivi e pertanto si consiglia profilassi antibiotica soprattutto nei primi mesi dopo l’impianto in caso di interventi dentari o di febbre di origine non chiara. Non esistono controindicazioni alla risonanza magnetica dopo impianto di Mitraclip.
Contatta l’esperto in merito a questo argomento
Dott. Renatomaria Bianchi
Cardiologo Emodinamista, esperto in diagnosi e trattamento percutaneo della cardiopatia ischemica e delle cardiopatie strutturali.
Dirigente Medico I livello
UOC Cardiologia e UTIC
Università della Campania L. Vanvitelli
AORN dei Colli – Ospedale Monaldi
Napoli